Напряжение на электролизере.
Для того, чтобы электрический ток прошел через электролизер, необходимо приложить определенное напряжение. При постоянной величине электрического тока I, чем выше сопротивление R в узлах электролизера, тем выше требуется напряжение U. Произведение U*I называется мощностью W, измеряемой в кВт. Произведение мощности на время (в часах) называется киловатт-часами и характеризует затраты электричества на проведение процесса. Следовательно, при прочих равных условиях, необходимо стремиться снизить напряжение на ванне.
Напряжение на работающем электролизере складывается из следующих величин:
- Uреакции — напряжение, требуемое для прохождения целевых реакций (осаждение покрытия, растворение анода и т.д.). Более правильно — это сумма обратимого напряжения разложения (разность равновесных или стационарных потенциалов катода и анода в данном электролите), катодной и анодной поляризации ή;
- Uтв проводники — напряжение, требуемое для прохождения электрического тока по твердым проводникам: покрываемым деталям, анодам, шинам, подвескам, проводам и т.д.
- Uконтакты — падение напряжения во всех контактах: места подключения проводов к источнику тока, места контакта проводов с шинами, шины с подвеской или анодными крючками, подвески и покрываемых деталей, анодных крючков и анодов;
- Uэлектролит — падение напряжения в электролите, определяющееся электропроводностью электролита;
- Uдиафр — падение напряжения в анодных чехлах, диафрагмах, колоколах, барабанах.Общее сопротивление работающей гальванической ванны можно, таким образом, выразить формулой:
- Как видно из формулы, чтобы снизить сопротивление на работающей ванне нужно:
- использовать твердые проводники с минимальным сопротивлением и достаточным сечением. При прохождении по ним тока (при недостаточном сечении) они могут разогреваться, что дополнительно повысит их сопротивление.
- своевременно чистить все перечисленные выше электрические контакты. Использовать максимально коррозионно-стойкие материалы.
- своевременно корректировать электролит и соблюдать режим электролиза. При прохождении электрического тока через электролит его температура может расти, что увеличит его электропроводность, в отличие от твердых тел.
- по возможности не использовать чехлы и диафрагмы (при цинковании, например, анодные чехлы будут лишними, а вот при никелировании на подвесках – незаменимыми).
Конверсионные процессы (Химическое оксидирование , Анодирование, химическое фосфатирование).
Главное отличие этих процессов — Вы не наносите покрытие поверх изделия, а производите его из самого металла изделия. Грубо говоря, на поверхности образуется защитная корочка. Поэтому после покрытия размеры изделия практически не увеличиваются (защитная пленка растет вовнутрь)
Еще важное отличие — полярность. Для обычных покрытий изделие является катодом и его цепляют на «-». Здесь же все наоборот. Изделие является анодом и его цепляют на “+”.
Химическое оксидирование (Хим.окс) применятся для стальных или алюминиевых изделий. После покрытия на поверхности образуется очень тонкая защитная корочка. (2-3мкм).
Анодирование (Ан.окс) – для алюминия. В этом случае защитная корочка толще (20-40мкм).
Фосфатирование (Хим.фос) – для стальных изделий. На поверхности образуется пленка из соли железа (фосфаты, 20-40мкм).


Рисунок 3 — Химическое оксидирование

Рисунок 4 — Химическое фосфатирование
Покрытия отличаются относительно низкой стоимостью. (особенно Хим.окс)
Оборудование. Актуально для гальваники в домашних условиях.
Емкости для растворов. Именно в них будут содержаться наши рабочие электролиты. Емкости лучше выбирать бесшовные, но это не обязательное требование.
ПОДОЙДЕТ любая полипропиленовая или полиэтиленовая посуда, баночки для специй, обрезки канистр и пр. В крайнем случае – новые эмалированные кастрюли, пока эмаль не растрескается (после этого стальная основа быстро корродирует, загрязняя раствор, а при сильной коррозии электролит может просто вытечь).
НЕ ПОДОЙДЕТ металлическая посуда, лавсан, ПЭТ бутылки из-под воды или минералки. Надеемся, что более экзотические материалы типа глины, дерева, ДСП вам в голову и не приходили.
ТЕХНИКА БЕЗОПАСНОСТИ. Емкости должны быть герметичные и конструкционно жесткие, чтобы их не “расперло” в залитом состоянии. Проверять лучше обычной водой. Для усиления вокруг емкости можно пустить обвязку из дерева, металла, полимерных тросов.
Шины токоведущие. В верхней части емкости нужно будет сделать надрезы для крепления шинок или толстой проволоки, взятой из проводов. Шины далее будут подключаться к источнику тока. Если мы хотим осаждать металл, то одна шина, на которую и будет завешиваться деталь, подключается к (-), две других к (+), слева и справа от нее. На них разместятся аноды. При анодном оксидировании все делается наоборот. Сечение шин нужно выбирать исходя из ампеража постоянным током – чем выше, тем толще.
ПОДОЙДЕТ медная шина или проволока. И то и другое можно найти в электротехнических магазинах.
НЕ ПОДОЙДЕТ алюминий и сталь, т.к. они очень быстро корродируют, на них не получиться добиться хорошего долговременного контакта с деталью. Исключение – электрохимическое обезжиривнаие, когда шины могут быть сделаны из стали, но обязательно должны быть погружены в раствор.
ТЕХНИКА БЕЗОПАСНОСТИ. Шины (-) и (+) не должны касаться друг друга. При обкусывании проволоки нужно защитить глаза от попадания мелких частичек. Чтобы случайно не закоротить катодную и анодную шину их концы можно заизолировать изолентой.
Аноды (противоэлектроды). При осаждении металлов аноды делают либо из того металла, который наносят, либо нерастворимыми – из нержавеющей стали, титана, свинца. При получении оксидов (анодировании) сама деталь выполняет роль анода и противоэлектроды к ней – катоды, делаются, как правило, из свинца и его сплавов.
ПОДОЙДЕТ любая пластинка из соответствующего материала. Лучше, чтобы она была побольше, но не превышала размеры покрываемой детали (в сумме по площади). Иначе есть риск получения “пригаров” на краях детали. Можно завешивать несколько противоэлектродов на одной шине.
НЕ ПОДОЙДЕТ пластина из смешанных разных материалов, непонятного состава.
ТЕХНИКА БЕЗОПАСНОСТИ. Свинец очень токсичен. Его не следует брать голыми руками, вдыхать его пыль при механической обработке. Отливать свинец дома – совсем плохая затея! Признаком попадания свинца в организм является сладковатый привкус во рту).
Электролиты. Раствор, в котором происходят нужные нам реакции под током. Под каждый процесс нужен свой раствор. Какие-то компоненты, типа медного купороса или аккумуляторной серной кислоты можно купить в магазине, другие – нет. Электролит получается после разведения требуемых реагентов в воде до рецептурных концентраций. Мы рассмотрим составы растворов в отдельной статье.
ТЕХНИКА БЕЗОПАСНОСТИ. Работать с электролитами лучше в латексных или нитриловых перчатках, обязательно в очках и под вытяжкой. Попадание растворов на кожу как правило не смертельно, но есть некоторые, способные вызвать ожоги (сильнощелочные или сильнокислые). Попадание азотной кислоты и хромовых солей на кожу почти моментально приводит к ее пожелтению. Хранить приготовленные электролиты можно в таре подобной рабочим емкостям. Однако, она должна быть герметично закрыта и находиться в недоступном для детей месте. Многие растворы имеют окраску и дети могут подумать, что это газировка или что-нибудь вкусненькое. ВСЕ ЭЛЕКТРОЛИТЫ ТОКСИЧНЫ ДЛЯ ЧЕЛОВЕКА!!!
Электролиты нельзя выливать в канализацию, как и промывные воды после них. Это наказуемое действие. Что делать с ними – это ваша личная ответственность!
Источник постоянного тока. Нужен прибор, преобразующий переменный ток в постоянный. Он называется выпрямитель. Он, кроме этого, понижает напряжение тока и повышает его ампераж.
ПОДОЙДЕТ фабричный выпрямитель с плавной регулировкой тока, стабилизацией по напряжению и пульсациям. Но он, как правило, неоправданно дорог, в пересчете на стоимость 1А выдаваемого тока. Отличная замена – зарядники для автомобильных аккумуляторов. Наилучшим решением являются ОРИОНы. Самые мощные из них выдают до 20А при 20В. Их применимость многократно была проверена нами на практике.
НЕ ПОДОЙДЕТ зарядники для бытовой техники и телефонов, сварочные аппараты (они не рассчитаны на длительную работу под нагрузкой), выпрямители без регулировки (если не снабдить их реохордами).
ТЕХНИКА БЕЗОПАСНОСТИ. Выпрямитель – электрический прибор, поэтому к нему применяются все нормы электробезопасности. Нельзя работать с ним мокрыми руками, допускать попадания на него растворов, аэрозолей, выхлопов из ванны. В случае сильного окисления компонентов внутри прибора он может устроить короткий прощальный “фейерверк”.
Перемешивающие устройства. Многие растворы работают лучше, если их перемешивать. Можно использовать простую палочку и свои руки, но лучше доверить это дело “профессионалам”. Так, отлично подойдут аквариумные компрессоры. Чем больше объем аквариума, на который рассчитан компрессор, тем больше поток воздуха и интенсивнее перемешка.
ПОДОЙДЕТ аквариумный компрессор с плавной регулировкой. Без регулировки приборы менее универсальные, они могут слишком сильно перемешивать небольшие объемы электролитов, приводя к разбрызгиванию.
ТЕХНИКА БЕЗОПАСНОСТИ. Компрессор тоже электрический прибор, как и выпрямитель. Здесь не будем повторяться. Что важно – проверять его нужно на требуемом объеме ванны, заполненной водой. Лучше, чтобы в лицо полетели брызги воды, а не химического раствора, если мощность компрессора будет подобрана неправильно.
Нагреватели. Часть растворов гальванике работает с нагревом до 50-60° С. Большая температура нужна редко. Просто засунуть кипятильник не получится. Он очень быстро прокорродирует и сгорит. В случае пробоя изоляции и за счет высокой электропроводности наших растворов можно дополнительно получить удар током при соприкосновении с рабочей емкостью. Чем же нагреть раствор в гальванике?
ПОДОЙДЕТ. Аквариумные нагреватели. Правда, едва найдутся рыбки, которые любят горячее джакузи при температуре 50° С. Поэтому такие нагреватели снабжаются термостатами с весьма узким диапазоном температур. Удалять термостат самостоятельно не стоит, т.к. нарушается герметичность нагревателя, а они рассчитаны на полное погружение. И все-же, если нужна температура несколько выше 30° С, то они вполне подойдут.
Можно использовать водяную баню. Поставить емкость с раствором в кастрюлю с водой и подогреть. Важно, чтобы раствор не выплескивался в кастрюлю, иначе в ней создастся со временем коррозионная среда.
Самый лучший вариант – профессиональные химически стойкие нагреватели, но они не всегда доступны и всегда дорогие.
НЕ ПОДОЙДЕТ. Бытовые погружные нагреватели. По причинам, описанным выше. И уж точно не стоит пытаться поставить ванну на нагревательную плитку.
Вытяжка. Она не влияет напрямую на процесс гальванизации, но делает его более безопасным. Чем мощнее – тем лучше.
ПОДОЙДЕТ. В домашних условиях можно использовать кухонные вытяжные зонты, но имейте в виду – они не химстойкие. Решетка же в них вообще выполнена из алюминия, которые быстро гниет от многих испарений. Можно применить канальные вентиляторы, но придется все равно делать вытяжной зонт. Мощным решением для дома являются вентиляторы МАРС, высасывающие более 600 м3 воздуха в час.
НЕ ПОДОЙДЕТ. Напольные вентиляторы, любая система вентиляции, способная вредить другим людям.
ТЕХНИКА БЕЗОПАСНОСТИ. Вытяжку нельзя выводить в общую систему дома. За счет мощных вентиляторов вы будете передавливать испарения в квартиры соседей. Вообще, если вы собираетесь работать с парящими и аэрозолящими процессами – подумайте! По законодательству РФ ваши установки будут относиться к стационарным источникам выбросов, что влечет огромное количество последствий. Ответственность всегда лежит на вас, в.т.ч. и уголовная!
Достоинства и недостатки гальваники. Сравнение с горячим методом.
Как мы уже знаем, металл на поверхность можно наносить разными способами. Например, самый распространенный – горячий метод. Это когда изделие погружают в огромный бассейн расплавленного металла. Сравним его с гальваникой.
1) Можно максимально точно задавать толщину покрытия (точность до 1 мкм). В то время как у горячего метода толщина 50-400 мкм. Это особенно важно для высокоточных изделий. Будет неприятно, если из-за толстого покрытия Ваше изделие не пройдет в сборку по допускам.
2) Множество покрытий. Гальванически можно нанести более 40 различных металлов, горячим методом не более 10.
3) Настройка процесса. В гальванике можно корректировать раствор для получения покрытия с разными свойствами (например, блестящее или матовое хромирование).
4) Равномерность покрытия. Часто в изделиях с большим количеством внутренних полостей горячим методом невозможно достичь равномерную прокрываемость полостей, иногда полости остаются без покрытия вообще. В гальванике все относительно равномерно.
1) Низкая производительность. Относительно горячего метода, которым можно покрывать сотни тонн изделий в сутки. Гальванику дольше настраивают.
2) Высокая цена. Исходя из низкой производительности. Гальваника всегда дороже горячего метода, просто потому что требования к покрытию выше.
3) Требования к техническому заданию. Если Вы хотите качественное нанесение покрытия – максимально подробно опишите требования. Если не знать, что ты хочешь – получишь точно не то.
4) Редко подходит для особо-крупных изделий. Если у изделия большая площадь – на покрытие потребуется огромное количество тока. Мало предприятий в России имеют такие производственные мощности.
Гальванопластика и электроформинг.
Суть процесса в том, что покрываются неметаллические изделия (диэлетрики). Для этого вначале наносится токопроводящее покрытие, а затем детали гальванизируются.
Частным случаем покрытия диэлектриков является гальванопластика и металлизация отверстий в печатных платах. Гальванопластика подразумевает получение толстых, до нескольких миллиметров толщиной покрытий на готовых формах. После отделения покрытия от формы оно само по себе становится товарным изделием. Если форма остается внутри готовой детали, то процесс будет называться электроформинг.
Цена гальваники.
Первое, что нужно понять — единой цены на гальванику для всех изделий не существует. Почему?
Вот пример: Если указать цену за покрытие, скажем, 60р за 1 кг.
1кг это может быть металлический брусок, который по площади не занимает почти ничего. Или это может быть проволока в размотанном виде, занимающая половину комнаты. По цене оба изделия будут стоить 60р. А теперь представьте насколько сложней покрыть проволоку, чем брусок?
Существуют ориентировочные цены для стандартных покрытий. Ими пользуются снабженцы, когда необходимо прикинуть бюджет на проект. Но окончательную цену гальванические предприятия укажут только когда посмотрят на чертежи изделий или сами изделия вживую.
С ценами на гальванику НПП Электрохимия Вы можете ознакомиться здесь. А лучше отправьте заявку менеджеру.
Простые и комплексные электролиты в гальванотехнике.
Традиционно в гальванике применяются простые и комплексные электролиты. Отличие состоит в том, в какой форме находятся ионы осаждаемого металла. Простые электролиты содержат сульфаты, нитраты, хлориды и т.п. и осаждаемый металл в них находится в форме простой соли. Соответственно, электролиты будут называться сульфатные, нитратные, хлоридные и т.п. Если используется смесь солей, то название будет двойным, тройным и т.д., например, сульфатно-нитратные, сульфатно-хлоридные.
В комплексном электролите ион осаждаемого металла связан в комплекс. Характеристикой комплексного электролита является константа нестойкости комплекса – чем она меньше, тем прочнее комплекс. В электролитах, комплекс которых имеет минимальную константу нестойкости, металл осаждается с наибольшим перенапряжением и, соответственно, покрытие получается наиболее мелкокристаллическим, а рассеивающая способность электролита и равномерность покрытия по толщине – максимальная. На практике наиболее прочные комплексы получаются обычно с цианид-ионами.
Для примера рассмотрим таблицу 4, в которой приведены значения констант нестойкости комплексов серебра и рисунок 14, где приведены некоторые поляризационные кривые осаждения серебра из различных комплексов. По рисунку 14 можно заметить, что чем меньше константа нестойкости комплекса, тем больше поляризация, что визуально выражается в более пологой кинетической кривой.
На практике часто применяются следующие виды комплексных электролитов: цианидные, аммиачные, пирофосфатные, роданистые, гидроксидные, борфтористоводородные. Другие комплексы применяют
Таблица 4 — Значения констант нестойкости некоторых комплексов серебра.
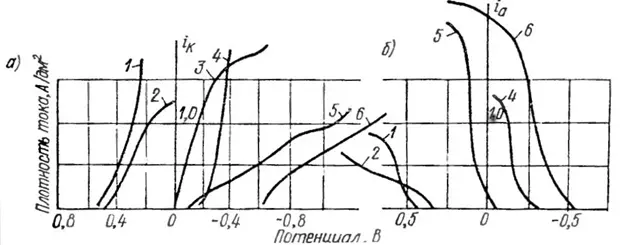
Рисунок 14 — Катодные (а) и анодные (б) поляризационные кривые серебра при одинаковом содержании его в электролите: 1- пирофосфатный, 2 – роданистый, 3 – йодистый, 4 – синеродистороданистый, 5 – цианистый, 6 аммиакатносульфосалицилатный.
§ 13. Гальваник 3-го разряда.
Гальваническое покрытие наружных и внутренних поверхностей изделий и деталей сложной конфигурации с труднодоступными для покрытия местами. Размерное хромирование и никелирование по 8 – 10 квалитетам деталей машин, приборов, двигателей, электрорадиоаппаратуры и агрегатов. Установка несложных дополнительных анодов. Гальванопластическое изготовление сложных деталей для электровакуумных приборов и алмазного инструмента. Наращивание медных и никелевых покрытий определенной толщины. Сернокислотное и хромокислотное оксидирование. Самостоятельное приготовление электролитов и растворов. Нейтрализация и регенерация отработанных электролитов и растворов. Рациональное использование вместимости ванн, установление и поддержание заданных режимов их работы. Определение качества гальванической обработки деталей на промежуточных операциях и готовой продукции внешним осмотром, измерительным и контрольным инструментами, механическими и химическими способами. Подналадка и регулировка ванн. Эматалирование защитное и декоративное деталей средней сложности.
Устройство электролизных ванн; причины возникновения и разновидности коррозии металлов и способы предохранения от нее; особенности подготовительных и отделочных операций и их последовательность перед покрытием; материалы, применяемые в гальваностегии, и их основные свойства; вредные примеси в электролитах, их влияние на гальванические осадки и способы их удаления; рецептуру изоляционных паст; нейтрализацию и регенерацию отработанных электролитов и растворов; устройство универсальных и специальных приспособлений и контрольно-измерительных приборов и инструментов.
1. Бачки и цилиндры разнообразные, котлы для пищи, мясорубки, самовары, кипятильники и другие емкости – лужение гальваническое, оцинкование, кадмирование и никелирование.
2. Бачки, крышки, оси стальные – трехслойные покрытия с изоляцией отдельных мест с применением дополнительного анода.
3. Валики ступенчатые, втулки, маховики, штоки разных размеров – хромирование и никелирование.
4. Валы – наращивание меди на посадочных участках для восстановления их размеров.
5. Детали игрушек – никелирование.
6. Детали приборов – покрытие драгоценными металлами с определением контрольной массы (привеса).
7. Детали насыщения кондиционеров, воздухораспределителей, диффузоров – защитное эматалирование.
8. Детали светильников – декоративное покрытие медью.
9. Детали цилиндрические различные (пальцы, кольца, втулки ) – наращивание стали, меди и хрома с целью восстановления размеров.
10. Жалюзи воздухораспределительные, раструбы концевые, трубы различной конфигурации в системах кондиционирования судовой вентиляции – защитное эматалирование.
11. Звездочки для цепных передач разных размеров – хромирование.
12. Изделия бытового назначения – защитное и декоративное эматалирование.
13. Инструмент измерительный (калибры резьбовые, скобы) – хромирование.
14. Колеса рабочие, диффузоры к электровентиляторам (сварные и клепаные) – защитное эматалирование.
15. Кольца зубчатые с внутренними шлицами – хромирование с проверкой покрытия на пористость и прочность.
16. Кольца поршневые – пористое хромирование, меднение.
17. Корзины хозяйственные, подставки, захваты для банок, мыльницы проволочные – никелирование, оцинкование.
18. Корпуса, каркасы, обшивки к каркасам, каплеотделители в сборе для изделий системы кондиционирования воздуха (сварные и клепаные) – защитное эматалирование.
19. Крестовины прибора – серебрение под калибр.
20. Кожухи и платы алюминиевые различной электро- и радиоаппаратуры – анодирование.
21. Лепестки, контакты, штепсельные гнезда, штыри контактные – серебрение.
22. Обтекатели – покрытие с дополнительными анодами.
23. Отстойники, решетки автомашин, головки вентиляторов, рупоры мегафонов – никелирование с внутренней обработкой.
24. Пресс-формы и пуансоны простой конфигурации – хромирование с изоляцией и простыми дополнительными анодами.
25. Рамки взрывозащитные для кинескопов – никелирование (подслои), оцинкование и пассивирование.
26. Сетки различного вида (кроме мелкоструктурной) и фиксаторы для специальных электронно-лучевых трубок – изготовление гальванопластическим методом.
27. Ступицы, маховики и рукоятки к ним, панели пультов управления к металлорежущим станкам – хромирование, полирование.
28. Трубы диаметром до 200 мм – гальваническое покрытие.
29. Трубы и баллоны – никелирование.
30. Фары и прожекторы – серебрение гальваническое для повышения отражения света.
31. Циферблаты часов – пассивирование.
32. Цоколи, штырьки, стержни, фланцы различных электровакуумных приборов – никелирование.
33. Якоря сердечников и сердечники реле локомотивов – гальваническое покрытие.
Потенциал электрода. Перенапряжение (поляризация).
Металлические электроды, опущенные в раствор электролита, содержащего одноименные с металлом ионы, обладают характеристикой, называемой равновесным потенциалом.
При использовании нерастворимых анодов или при опускании анода в раствор, в котором отсутствую одноименные ему ионы, на нем будет реализовываться стационарный потенциал.
Равновесный потенциал привязан к величине стандартных потенциалов металлов (табличные значения) уравнением Нернста:
E = E0+RT/nF*lnaOx/aRed
E = E0+0,0592/n*lgaOx/aRed
Когда мы приложим к электродам установки разность потенциалов (проще говоря подключим источник постоянного тока) потенциал электрода будет смещаться от равновесного значения. В гальванике принято считать, что смещение катодного потенциала идет в отрицательную область, а анодного – в положительную, хотя это и условно (можно принять и обратное отношение знаков).
Смещение электродных потенциалов от равновесного значения под действием приложенного извне напряжения называется поляризацией, разница между равновесным потенциалом и потенциалом под током – перенапряжением. Поляризация и перенапряжение, по сути, синонимы. Степень зависимости плотности тока от потенциала называется поляризуемость.
Перенапряжение обозначается как ηК и ηА соответственно для обозначения катодного и анодного процесса.Наглядно эти вопросы будут разъяснены при рассмотрении поляризационных кривых.
Отметим, что чем выше перенапряжение выделения металла на катоде, тем более мелкокристаллическим будет покрытие. При осаждении покрытий стремятся получать как можно более мелкокристаллические осадки. Обоснование этого будет дано далее.
Следует также запомнить общее правило: на катоде идут преимущественно электроположительные процессы, на аноде – электроотрицательные.

§ 12. Гальваник 2-го разряда.
Гальваническое покрытие с наружной и внутренней стороны простых изделий и деталей с прямыми и криволинейными плоскостями, имеющими впадины и выступы. Гальваническое лужение. Гальванопластическое изготовление простых и средней сложности изделий для электровакуумных приборов. Подготовка деталей к гальваническому покрытию. Загрузка ванн химикатами по установленной рецептуре. Изоляция поверхности деталей и изделий, не подлежащих покрытию. Регулирование гальванических процессов по приборам и заданным режимам. Снятие бракованного покрытия. Составление по установленным рецептам электролитов и растворов под руководством гальваника более высокой квалификации. Защитное эматалирование деталей и изделий простой конфигурации.
Принцип действия электролитных ванн; основные виды гальванических покрытий и основы электролиза; основы электроники и электрогамии в пределах выполняемой работы; режимы гальванических покрытий деталей и изделий; правила подвода дополнительных анодов; способы изоляции поверхностей деталей и изделий, не подлежащих гальваническому покрытию; свойства кислот, щелочей и цианистых солей; назначение и условия применения специальных приспособлений и контрольно-измерительных приборов и инструментов.
1. Арматура паровых машин и турбин (парозапорные клапаны, смазочные насосы, тахометры, вентильные коробки, редукционные клапаны) – оксидирование.
2. Воронки, вилки, вешалки, башмаки, подвески, краники, крючки, капельницы – никелирование.
3. Гайки, краны водопроводные, оправы термометров, рупоры, пружины плоские и спиральные – никелирование с двумя подслоями (матовое).
4. Детали крепежные для изделий системы кондиционирования воздуха, электровентиляторов – защитное эматалирование.
5. Детали бытовой электроосветительной арматуры средней сложности – декоративное гальваническое покрытие.
6. Детали приборов – анодирование.
7. Детали керамические – гальваническое покрытие.
8. Детали надводных трапов кораблей, трапов подводных лодок, детали ограждения для трапов, скобы, коуши, обушки, таллеры – оцинкование с пассивизацией.
9. Детали электро- и радиоаппаратуры (экраны, панели, каркасы, кожухи, фигурные кронштейны) – оцинкование с пассивизацией.
10. Доски фирменные, планки отличительные, шкалы стальные – хромирование.
11. Козырьки, отбойные листы, решетки кольцевые в системах кондиционирования и судовой вентиляции – защитное эматалирование.
12. Кольца уплотнительные, крепеж специальный, крышка – хромирование, оксидирование.
13. Кронштейны всех размеров с частичной изоляцией поверхностей – анодирование, оксидирование.
14. Листы, угольники, фланцы – химическое оксидирование.
15. Ниппели, угольники, экраны – кадмирование.
16. Планки, полосы, скобы и другие малогабаритные детали простой конфигурации – защитное эматалирование.
17. Сетки мелкоструктурные медные – изготовление гальванопластическим методом.
18. Фланцы, шайбы, шестерни всех размеров – никелирование с двумя подслоями, оцинкование с изоляцией мест, не подлежащих покрытию.
19. Цепи и проволока различного сечения – лужение гальваническое.
20. Шестерни и кольца различных размеров – никелирование.
21. Шурупы для крепления всех металлических деталей внутренней аппаратуры, винты рам, прутки оконные и предохранительных решеток; полосы, ручки и личники дверные цельнометаллические вагонов – гальваническое покрытие.
1. Понятие об электролизе. Принципиальная схема электролизера.
2. Закон Фарадея. Выход по току. Расчет толщины осаждаемого покрытия.
3. Потенциал электрода. Перенапряжение (поляризация).
4. Напряжение на электролизере.
5. Лимитирующие стадии электродной реакции. Поляризационная кривая. Предельный диффузионный ток. Концентраторы тока.
6. Одновременное протекание реакций на электроде. Выделение металла одновременно с газом. Сплавообразование.
7. Простые и комплексные электролиты в гальванотехнике.
8. Химическое осаждение металлов.
Одновременное протекание реакций на электроде. Выделение металла одновременно с газом. Сплавообразование.
Случаи, когда при нанесении гальванического покрытия на электроде протекает только одна реакция довольно редки. Гораздо чаще происходит одновременно две и более реакции. Условием для одновременного протекания двух электрохимических процессов является максимальное сближение потенциалов их разряда. Можно классифицировать ситуации следующим образом:
- Восстановление (осаждение) металла одновременно с выделением водорода;
- Восстановление (осаждение) металла одновременно с одним или несколькими другими металлами, а также, иногда, неметаллами и органическими веществами.
Как правило, все процессы осаждения металлов в гальванике идут с одновременным восстановлением примесей из раствора (посторонние металлы, сера, органика и т.п.), продукты восстановления которых встраиваются в покрытие и вызывают изменение его физико-механических свойств – положительное или отрицательное. Примером положительно влияющей примеси (можно назвать ее легирующим компонентом) является висмут в сплаве олово-висмут, дающий улучшение коррозионной стойкости, предотвращение эффекта “оловянной чумы”, увеличение срока сохранения способности к пайке. Примером сплава с вредной примесью — никелевое покрытие, загрязненное медью (медь дает ухудшение прочности сцепления покрытия с основой, ухудшение внешнего вида — потерю блеска, образование грязно-серого покрытия, ухудшение защитных антикоррозионных свойств).
1 Выделение водорода одновременно с осаждением металла на катоде.
Выделение водорода одновременно с покрытием происходит, например, при никелировании, хромировании, цинковании из цинкатного электролита, лужении из кислого электролита и т.д. Выделение водорода усиливается при приближении к предельному диффузионному току.
Рассмотрим рисунок 8, на котором показаны поляризационные кривые одновременного выделения водорода и металла на катоде. При потенциале Е1 доля общего тока, приходящегося на выделение металла составляет примерно 2/3 общего тока, а выделения водорода – 1/3. При более отрицательном потенциале Е2 наоборот, доля тока осаждения металла составит 1/3 общего, а доля тока выделения водорода – 2/3. И чем более отрицательный потенциал мы будем задавать, тем больше будет доля тока выделения водорода в общей величине тока, пропущенного через электролизер.
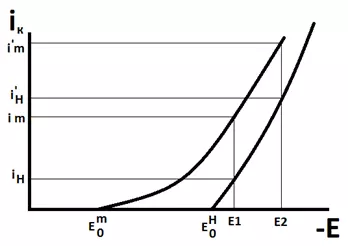
Рисунок 8 — Поляризационные кривые одновременного выделения металла и водорода.
Выделение водорода при катодном осаждении металла практически всегда отрицательно сказывается на качестве покрытия. Тому есть несколько причин:
- Водород может проникать в покрытие и металлическую основу, вызывая “водородную хрупкость” металлов.
- Водород может задерживаться на поверхности металла, вследствие чего покрытие будет расти вокруг пузырька газа. В результате будет образовываться ямочка, иногда доходящая до подложки — “питтинг”. Это особенно актуально для никелирования.
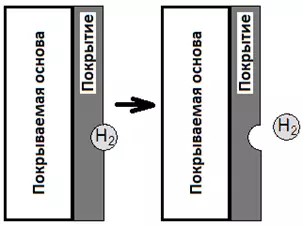
Рисунок 9 — Схема образования питтинга за счет пузырька водорода, прилипшего к покрытию
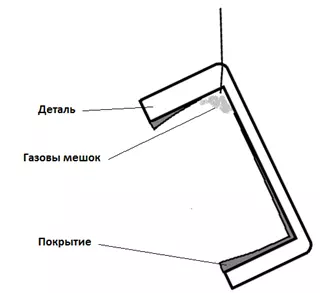
Рисунок 10 — Схема образования газовых мешков.
С другой стороны, очень редко водород может играть и положительную роль, например при щелочном цинковании из цинкатного электролита. Обильное выделение водорода в этом процессе позволяет доочистить поверхность покрываемых деталей от загрязнений и несколько улучшить прочность сцепления покрытия с основой в этом случае (здесь речь будет идти об “очищающем” действии электролита). Однако, не следует забывать и о том, что обильное выделение водорода одновременно с этим ухудшит физико-механические свойства покрытия за счет наводораживания и, соответственно, водородной хрупкости. Кроме этого, десорбирующийся из детали водород при сильно напряженном покрытии может вызывать появление отслоений в виде пузырей.
2 Одновременное выделение двух и более металлов или металла и неметалла (сплавообразование).
Сплавообразование может быть желательным и нежелательным. В первом случае мы целенаправленно хотим получить сплав с определенно заданными свойствами: олово-висмут, никель-фосфор и т.п. Во втором – мы не хотим получать сплав, но он образуется по причине особенностей техпроцесса или ошибок в нем. Так, при щелочном цинкатном цинковании с блескообразователями в покрытие может включаться до 1 % углерода из органических блескообразующих добавок. Изначально мы не хотим этого, но без введения органики в электролит покрытия требуемого качества мы не получим. Так же в никелевое покрытие, полученное из сульфатно-хлоридного электролита с органическими блескообразователями, встраивается сера. Таким образом, речь идет об особенностях техпроцесса. Однако, если электролит никелирования загрязнен медью, то включение меди в никелевое покрытие вызовет ухудшение его качества. Данного явления можно было бы избежать, т.к. медь попала в раствор из-за ошибки в техпроцессе (например, медные детали плохо промыли после подготовительных операций и остатки раствора травления попадали в ванну никелирования).
Для того, чтобы две электроактивных частицы одновременно восстановились на катоде нам необходимо максимально сблизить их потенциалы разряда. Этого можно достичь следующими способами:
- Связать одну из частиц в комплекс;
- Понизить концентрацию одного вещества, по сравнению с другим;
- Ввести ПАВ.
- Задать соответствующую плотность тока. Например, при осаждении бронзы (сплав медь-олово) в зависимости от плотности тока можно получать покрытие с различным содержанием олова – низкооловянную желтую бронзу или высокооловную белую бронзу из одного и того же электролита.
Лимитирующие стадии электродной реакции. Поляризационная кривая. Предельный диффузионный ток. Концентраторы тока.
Для того, чтобы иону металла восстановиться и осадиться на катоде ему необходимо подойти к поверхности электрода из объема раствора, разрядиться и встроиться в кристаллическую решетку покрытия. Все эти процессы характеризуются определенной скоростью. Стадия, имеющая минимальную скорость будет тормозить всю реакцию. Такая стадия будет называться лимитирующей (замедленной) и будет контролировать электрохимический процесс.
В электрохимической кинетике скорость процесса может контролироваться замедленной диффузией (переносом) разряжающихся ионов из глубины раствора к поверхности катода, их замедленным разрядом (переходом иона в металл) или смешанной кинетикой, когда при определенных потенциалах замедленной будет диффузия ионов, а при других – их замедленный разряд. Также существуют и другие лимитирующие стадии – замедленная кристаллизация и замедленная промежуточная химическая реакция.
От того, какая стадия процесса является лимитирующей будет зависеть вид поляризационной кривой – зависимости плотности тока от потенциала электрода.
На рисунке 4 представлены типичные виды поляризационных кривых.
Отметим, что в повседневной гальванотехнике поляризационные кривые в рабочих электролитах снимаются редко, поэтому детальное изучение кинетики электрохиимических реакций мы опустим, оставив это курсу теоретической электрохимии.
Рассмотрим прикатодное пространство в электролите при включении внешнего тока (рисунок 5).
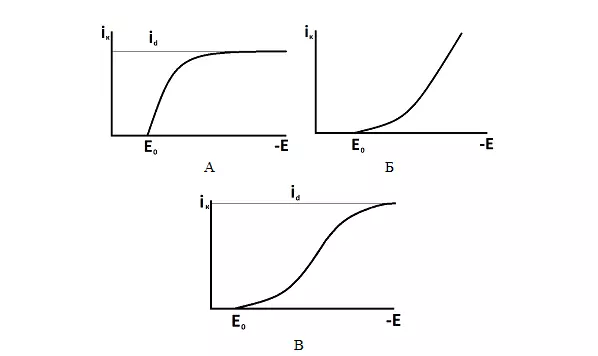
Рисунок 4 — Типичные виды поляризационных кривых: А – замедленная диффузия, Б – замедленный разряд, В – смешанная кинетика.
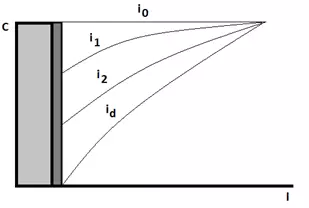
Рисунок 5 — Схема приэлектродного пространства в момент включения внешнего тока (зависимость концентрации ионов С от расстояния до катода L), где i0<i1<i2<id.
Первоначально в равновесном состоянии системы концентрация разряжающихся ионов в прикатодном пространстве высока и равна концентрации во всем объеме электролита.. При отсутствии внешнего тока в системе будет наблюдаться только ток обмена i0.
Ток обмена характеризует процесс перехода ионов металла из кристаллической решетки катода в раствор и обратно. Как только будет включен источник тока разряжающихся ионов в прикатодном слое начнет падать. Одновременно с этим из глубины электролита за счет диффузии будет происходить поступление новых ионов с определенной скоростью.
Если скорость диффузии будет меньше скорости разряда ионов, то концентрация разряжающихся ионов в приэлектродном пространстве с ростом плотности тока будет продолжать уменьшаться. При определенной плотности тока все подходящие из глубины раствора ионы будут сразу же разряжаться на катоде. Данная плотность тока будет называться предельным током. Увеличить скорость электроосаждения мы теперь уже не сможем, т.к. новые ионы просто не будут успевать подходить из глубины электролита к поверхности катода. Важно знать, что для любой реакции может быть достигнут предельный ток, когда скорость этой реакции достигнет предельного значения. В этом случае на поляризационной кривой будет получена площадка, параллельная оси потенциалов (т.е. оси х).
Отметим, что площадка предельного тока может носить диффузионный характер, либо, реже, кинетический (соответственно возникают термины предельного диффузионного тока и предельного кинетического тока).Предельный диффузионный ток (id) — ток, при котором скорости подвода ионов разряжающегося элемента (диффузии из объема электролита) уже не хватает для дальнейшего увеличения скорости электрохимической реакции восстановления данных ионов.
Предельный кинетический ток (iк) — ток, при котором скорость процесса полностью ограничивается скоростью медленной химической реакции, которая входит в суммарный электродный процесс (потеря комплексной разряжающейся частицей лиганда, димеризация продукта разряда иона и т.д.), а также скоростью проникновения разряжаемых частиц через слой адсорбированных на поверхности катода органических соединений (ПАВ: блескообразователей, выравнивающих добавок).
При перемешивании электролита будет увеличиваться величина предельного диффузионного тока и не будет изменяться величина предельного кинетического.
Понятие предельного диффузионного тока является крайне важным в гальванотехнике, т.к. в большинстве случаев при достижении такого тока получить компактное покрытие уже не удается – осаждается металл порошкообразной (дендритной) структуры. Таким образом возникает понятие рабочей плотности тока или, чаще, рабочего диапазона плотностей тока.
Диапазон рабочих плотностей тока — область плотностей тока, в которой можно получить качественное покрытие требуемой структуры и с требуемыми свойствами. Например, при меднении из сернокислого электролита без перемешивания рабочий диапазон составляет обычно 1-2 А/дм2. При меньшем токе покрытие может стать матовым, а при большем – порошкообразным. Особенно характерно диапазон рабочих плотностей тока проявляется при хромировании.
Принято считать, что рабочие плотности тока в гальванических процессах располагаются значительно ниже величин предельного диффузионного тока. Однако, есть примеры покрытий, осаждающихся на предельном токе – например, покрытие блестящим сплавом олово-висмут из сернокислого электролита с рядом органических добавок. Так, считается, что бескообразующие органические добавки, способствующие получению компактного блестящего гладкого покрытия, начинают действовать только на токах близких к предельным, тогда как при низких плотностях тока покрытие получается пористым шероховатым и мажущимся.
Учитывая сложную геометрию покрываемых деталей в гальванике важно понимать, что предельный ток может реализовываться не на всем электроде целиком, а на отдельных его частях (“концентраторах тока”) – острых кромках, выступах, а также в случаях, когда глубина погружения детали меньше глубины погружения анода и т.д. (рисунок 6,7).
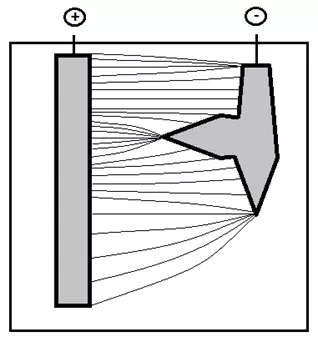
Рисунок 6 — Распределение силовых линий от более длинного анода к более короткому катоду, на котором имеются “концентраторы тока”.

Рисунок 7 — Пример никелированной детали, на которой имеются углы — “концентраторы тока”.
На таких местах будет образовываться так называемый “пригар” — участок покрытия темного, серого (вплоть до черного) цвета, имеющего порошкообразную структуру (рисунок 8).

Рисунок 8 — Пример микроструктуры порошкового медного покрытия на медной подложке.Также, на таких участках может значительно повышаться рН за счет расходования ионов H+ на выделение газообразного водорода. В этом случае может достигаться рН гидратообразования для некоторых металлов. например, никеля, и мы увидим еще и отложения гидроксидов металла.
Если параллельно с осаждением металла на катоде идет выделение водорода (как это имеет место, опять же, при никелировании), то в местах реализации предельного диффузионного тока будет наблюдаться значительно большее газовыделение, чем на остальной поверхности катода. Учитывая крупнокристаллическую структуру покрытия и его плохое сцепление с основой в этих местах, а также значительную скорость его наращивания, выделяющийся водород может просто срывать крупные части покрытия (эффект старой краски, отслаивающейся от покрашенного изделия) вызывая брак всего изделия. Для увеличения значения предельного диффузионного тока и, соответственно, расширения рабочих плотностей тока, как уже говорилось ранее, производится перемешивание электролитов.
Обсуждение с заказчиком технического задания и подготовка электролита.
Изделие нельзя просто начать покрывать, как только его привез клиент. Обязательно требуется техническое задание (ТЗ) на гальваническое покрытие. Если цель клиента – красивый сувенир, который будет лежать на полке – выбираем хром или никель. Цель – защита стального изделия от коррозии на 20 лет – выбираем цинк. А для хорошей электропроводности шины в электротехническом шкафу – олово/серебро/никель. И т.д.
Здесь же требуется оговорить толщину покрытия. Чем больше толщина – тем лучше покрытие защищает изделие, но и цена покрытия выше.
Если ТЗ на гальванику у Заказчика не имеется – достаточно словесного описания, какие свойства необходимы для изделия. Или в каких условяих будет работать деталь. Грамотный менеджер сам подберет гальваническое покрытие. Вы можете позвонить в наш офис для бесплатной консультации.
Подготовка электролита. Гальванические предприятия работают на заранее приготовленных штатных электролитах. Растворы надежны, проверены и подходят для большинства заказов. Но в ряде случаев требуется развести персональный раствор для достижения определенных характеристик покрытия. Перед каждым запуском нового заказа в работу инженеры анализируют, подойдет ли штатный раствор или нужен персональный.
Понятие об электролизе. Принципиальная схема электролизера.
Гальваника — это осаждение металла или оксида на поверхности изделия для придания ему новых функциональных свойств или улучшения внешнего вида. Гальваника выполняется под действием электрического тока, отсюда возникает понятие “электролиз”.
Электролиз с практической точки зрения является комплексом окислительно-восстановительных реакций, протекающих под действием электрического тока в электролите.
Электролит – это среда (для классической гальваники – водный раствор), обладающая ионной электрической проводимостью. Проще говоря – жидкость, способная проводить через себя электрический ток. Электрический ток проводится в основном за счет сольватированных в растворителе ионов. Сольватация является своего рода “растаскиванием” ионов из прочной кристаллической решетки твердого вещества диполями воды. В результате каждый ион становится окружен некоторым количеством молекул воды и в этом виде передвигается либо к положительному, либо к отрицательному электроду.
Когда через электролит пропускается электрический ток, то первоначально происходит направленное движение электронов в металлических проводниках. От анода электроны переходят к катоду, в результате чего на аноде образуется избыточный положительный заряд. При включенной электрической цепи с внешним источником тока на растворимом аноде будет происходить отнятие электронов у атомов металла-основы анода, а на нерастворимом – отнятие электронов у тех анионов, которые находятся в прианодной области. На катоде же появляется избыточный отрицательный заряд за счет скопившихся на нем электронов. К положительному аноду начинают движение противоположно заряженные анионы, а к катоду – катионы. При этом достигнув электродов они могут претерпевать определенные химические превращения.
Проходящий через электролит ток обычно постоянный, хотя иногда он может быть и переменным или изменяться по определенной функции. В любом случае, мы всегда сможем выделить катодный (восстановление) и анодный (окисление) процессы.
Электролиз не обязательно должен происходить только в водных растворах. Существуют также неводные электрохимические системы на основе органических (в основном апротонных) растворителей, солевых расплавов и даже твердых электролитов, однако их применение в промышленности для получения металлических покрытий ограничено, а в случае твердых электролитов – вообще невозможно.
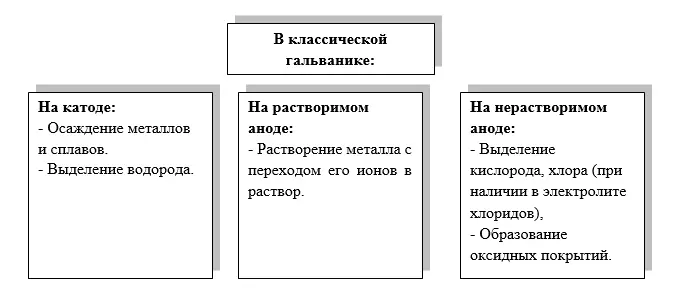
В гальванике, исходя из вышеприведенной схемы, может быть три варианта организации процесса:1. Электролиз с растворимыми анодами. Металл анода растворяется и его ионы переходят в раствор, а на катоде эти же ионы восстанавливаются и осаждается металлическое покрытие. Примеры такого процесса – цинкование, меднение, никелирование и т.п.
2. Электролиз с нерастворимыми анодами. Анод не растворяется, на нем происходит побочная реакция, например, выделение кислорода. На катоде происходит восстановление металла, ионы которого подтягиваются из электролита. Происходит непрерывное снижение концентрации ионов металла в растворе.
3. Анодирование — получение оксидного покрытия на детали, завешенной в ванну анодом, на катоде идет выделение водорода.Устройство для проведения электролиза называется электролизером. Небольшой лабораторный электролизер принято называть ячейкой, в то время как промышленная установка будет называться гальванической ванной.
Схема простейшего электролизера (рисунок 1 и 2) всегда включает в себя:
- электролит, через который протекает электрический ток;
- катод(ы) – покрываемые детали (отрицательный электрический полюс, на котором происходит процесс принятия электронов – восстановления). Катод, на который наносится покрытие также может называться подложкой или основой, а покрытие на катоде – осадком;
- аноды – противоэлектроды (положительный электрический полюс, на котором происходит процесс отдачи электронов – окисления);
- источник электрического тока.
В случае нанесения анодного оксидного покрытия, например, на алюминии (процесс анодирования), покрываемые изделия находятся на аноде, а катоды выполняют роль противоэлектродов.
Электролизер может комплектоваться и дополнительным оборудованием:
- нагреватели;
- системы перемешивания;
- системы фильтрации;
- бортовые отсосы;
- крышки;
- датчики технологических параметров (температуры, рН, уровень, потенциал, концентрация компонентов и т.п.), дозаторы и другие средства автоматизации.
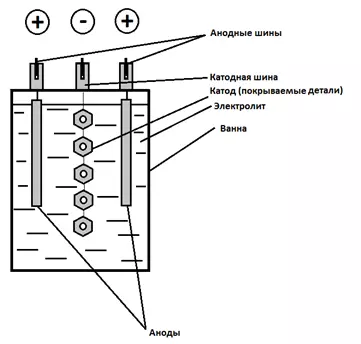
Рисунок 1 – Принципиальная схема электролизера

Рисунок 2 – Реальный электролизер (гальваническая ванна блестящего цинкования из щелочного цинкатного электролита).
Техпроцесс в гальванике.
1) Осмотр и предварительные операции
Перед началом работ изделие внимательно осматривают на наличие дефектов, отмывают от грязи, пыли, заусенцев, толстого слоя жира. Если изделие не имеет отверстия для крепления – его необходимо проделать (не всегда).
2) Навязка на проволоку
В раствор изделие погружают на проволоке. Поэтому при расчете, какую толщину проволоки выбрать и сколько подвязок соорудить, необходимо учитывать вес изделий. По проволоке (как правило, медной) будет идти ток, поэтому сечение (толщина) проволоки выбирается исходя из того, какой общий ток подается на подвеску. В ряде случаев навязка на проволоку не производится, например, если изделия покрываются в барабане.
Далее после каждого процесса изделия необходимо промывать. Это делают чтобы избежать попадания одного раствора в другой и для более качественного покрытия.
3) Обезжиривание химическое
Следующим этапом является химическое обезжиривание. На любом изделии присутствует жировая пленка, мещающая качественному нанесению покрытия. Пленка удаляется моющим средством.
4) Обезжириванние электрохимическое
Аналогичная операция, только здесь на изделия дополнительно подают ток. В конце процесса даже тончайшая жировая пленка удаляется.
Это удаление оксидов на изделии (ржавчина, окалина и т.д.). Здесь нужно быть особенно аккуратным, т.к. для травления используют кислоты (соляную, серную) или концентрированную щелочь. Процесс необходим для получения качественного сцепления покрытия с изделием. Если работаем со сталью – после травления изделие начнет ржаветь через 10-30 секунд. Поэтому его нужно максимально быстро промыть и отправить на сл. этап.
6) Нанесение гальванического покрытия
Собственно сам процесс. Производится на исключительно чистую подготовленную поверхность. Аноды растворяются, металл осаждается на изделиях.
7) Дополнительные операции (не всегда).
Иногда после нанесения гальванического покрытия его требуется доработать. Например, отполировать для блеска.
Влажное изделие не рекомендуется использовать сразу. После гальваники в первые сутки нанесенный металл активен, любит впитывать в себя грязь, жир от пальцев и т.п. Поэтому лучше чтобы после интенсивной сушки в сушильном шкафу изделия сутки полежали при комнатной температуре на складе.
9) Контроль гальванического покрытия
Соответствие техническим требованиям заказчика проверяет специалист Отдела Технического Контроля (ОТК). Измеряет толщину, адгезию (прочность сцепления), блеск, паяемость и кучу других параметров. Если все в порядке – для изделий выписывается сертификат качества, и они едут к заказчику. Если нет – изделия возвращаются в цех для снятия бракованного покрытия и нанесения нового качественного.
НПП Электрохимия выполняет полный цикл работ по нанесению гальванических покрытий. После нанесения покрытия и его проверки мы выдаем паспорт (сертификат) качества. Это особенно важно в рамках выполнения ГОЗ.
Гальваника своими руками в домашних условиях
Вообще мы не рекомендуем Вам самим заниматься гальваникой в домашних условиях. Лучше обратитесь на гальваническое производство (можно и к нам :)). Сбережете здоровье и нервы.
Если Вы все же решились — про необходимое оборудование мы уже написали в п.7. Настоятельно рекомендуем заниматься гальваникой дома только как хобби, когда покрываются штучные детали и для себя.
По мере написания мы будем выкладывать статьи по нанесению определенных металлов дома:
-Серебрение и т.д.
Химическое осаждение металлов.
Процесс химического осаждения металлов (ХОМ) представляет собой окислительно-восстановительную реакцию. продуктом которой является металл:
Термодинамическая вероятность такой реакции определяется разностью потенциалов восстановителя и окислителя, с одной стороны, и устойчивостью воды — с другой стороны, т. к. многие металлы разлагают воду и не могут быть выделены из водных растворов.
В качестве восстановителя могут быть использованы гипофосфит-ион, формальдегид, борогидрид, гидразин, ионы металлов переменной валентности (Sn2+, Ti3+ и др.). Соответствующие уравнения приведены в таблице 5. Термодинамически протекание какой-либо реакции возможно в той области рН и потенциалов, где устойчивы состояния продуктов этой реакции. Применительно к ХОМ это означает, что реакция протекает в области, где металл находится в восстановленной форме, а восстановитель – в окисленной. Для обеспечения протекания окислительно-восстановительного процесса ХОМ необходимо увеличение восстановительной способности восстановителя (например, формальдегида), что достигается смещением рН в сторону больших
Таблица 5 – Уравнения, описывающие системы “восстановитель-вода”; в щелочных растворах.
Введение лиганда существенно смещает потенциал восстановления ионов металла (например, меди) в область отрицательных значений.
Данная статья является интеллектуальной собственностью ООО “НПП Электрохимия”. Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
